USTEKINUMAB – STELARA
Pagina creata il 18/09/2018. Ultimo aggiornamento 09/08/2023
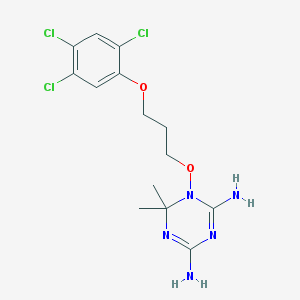
Nome IUPAC dell’Ustekinumab: 6,6-dimethyl-1-[3-(2,4,5-trichlorophenoxy)propoxy]-1,3,5-triazine-2,4-diamine
Nome commerciale e formulazioni:
- STELARA 45 mg soluzione iniettabile
- STELARA 45 mg soluzione iniettabile in siringa preriempita
- STELARA 90 mg soluzione iniettabile in siringa preriempita.
- STELARA 130 mg concentrato per soluzione per infusione
Ustekinumab è un anticorpo monoclonale IgG1κ interamente umano, che lega interleuchina (IL)-12/23, prodotto in una linea cellulare di mieloma murino, usando la tecnologia di DNA ricombinante.
SCHEDA TECNICA DI STELARA (RCP) (fonte: EMA – 09/08/2023)
riassunto della relazione pubblica europea di valutazione per Stelara destinato al pubblico
INDICAZIONI (STELARA 45 mg e 90 mg)
Psoriasi a placche
STELARA è indicato per il trattamento della psoriasi a placche di grado da moderato a severo, in pazienti adulti che non hanno risposto, o che presentano controindicazioni o che sono intolleranti ad altre terapie sistemiche, incluse ciclosporina, metotrexato (MTX) o PUVA (psoraleni e raggi ultravioletti A) (vedere paragrafo 5.1 dell’RCP).
Artrite psoriasica (PsA)
STELARA, da solo o in associazione a MTX, è indicato per il trattamento dell’artrite psoriasica attiva in pazienti adulti quando la risposta a precedente terapia con farmaci antireumatici modificanti la malattia non biologici (DMARDs) è risultata inadeguata (vedere paragrafo 5.1 del’RCP).
Psoriasi a placche nei pazienti pediatrici
STELARA è indicato per il trattamento della psoriasi a placche di grado da moderato a severo in pazienti adolescenti a partire dai 6 anni di età che non sono adeguatamente controllati da altre terapie sistemiche o fototerapia o ne sono intolleranti (vedere paragrafo 5.1).
Malattia di Crohn
STELARA è indicato per il trattamento di pazienti adulti affetti da malattia di Crohn attiva di grado da moderato a severo che hanno avuto una risposta inadeguata, hanno perso la risposta o sono risultati intolleranti alla terapia convenzionale o ad un antagonista del TNFα o che hanno controindicazioni mediche per tali terapie.
Colite ulcerosa
STELARA è indicato per il trattamento di pazienti adulti con colite ulcerosa attiva di grado da moderato a severo che hanno avuto una risposta inadeguata, hanno perso la risposta o sono risultati intolleranti alla terapia convenzionale o ad una terapia biologica oppure che presentano controindicazioni mediche a tali terapie (vedere paragrafo 5.1).
INDICAZIONI (STELARA 130 mg)
Malattia di Crohn
STELARA è indicato per il trattamento di pazienti adulti affetti da malattia di Crohn attiva di grado da moderato a severo che hanno avuto una risposta inadeguata, hanno perso la risposta o sono risultati intolleranti alla terapia convenzionale o ad un antagonista del TNFα o che hanno controindicazioni mediche per tali terapie.
Colite ulcerosa
STELARA è indicato per il trattamento di pazienti adulti con colite ulcerosa attiva di grado da moderato a severo che hanno avuto una risposta inadeguata, hanno perso la risposta o sono risultati intolleranti alla terapia convenzionale o ad una terapia biologica oppure che presentano controindicazioni mediche a tali terapie (vedere paragrafo 5.1 dell’RCP).
CONTROINDICAZIONI
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1 dell’RCP.
Infezione attiva, clinicamente rilevante (per esempio tubercolosi attiva; vedere paragrafo 4.4 dell’RCP).
Meccanismo d’azione
Ustekinumab è un anticorpo monoclonale IgG1κ interamente umano che lega con specificità la proteina p40, subunità condivisa delle interluchine (IL)-12 e IL-23, citochine umane. Ustekinumab inibisce l’attività biologica di IL-12 e di IL-23 umane, impedendo il legame di p40 con la proteina recettoriale IL-12Rβ1 espressa sulla superficie delle cellule immunitarie. Ustekinumab non può legarsi a IL-12 o a IL-23 che sono già legate ai recettori IL-12Rβ1 presenti sulla superficie cellulare. Quindi, è improbabile che ustekinumab contribuisca alla citotossicità complemento-mediata o anticorpomediata delle cellule con i recettori di IL-12 e/o IL-23.
IL-12 e IL-23 sono citochine eterodimeri secrete da cellule attivate presentanti l’antigene, come macrofagi e cellule dendritiche ed entrambe le citochine partecipano all’attività immunitaria; IL-12 stimola le cellule natural killer (NK) e conduce la differenziazione delle cellule T CD4+ verso il fenotipo T helper 1 (Th1), IL-23 induce il pathway del T helper 17 (Th17). Tuttavia, la regolazione anomala di IL-12 e IL-23 è stata associata a patologie immuno-mediate, come la psoriasi, l’artrite psoriasica e la malattia di Crohn.
Attraverso il legame alla subunità p40 condivisa di IL-12 e IL-23, ustekinumab può esercitare i suoi effetti clinici nella psoriasi, nell‘artrite psoriasica e nella malattia di Crohn e nella colite ulcerosa, interrompendo i pathway citochinici di Th1 e Th17, che sono cruciali per la patologia di queste malattie.
Nei pazienti con malattia di Crohn, il trattamento con ustekinumab ha comportato una diminuzione degli indici infiammatori tra cui la proteina C-reattiva (PCR) e la calprotectina fecale durante la fase di induzione; tale riduzione è stata poi mantenuta per tutta la fase di mantenimento. La PCR è stata valutata durante lo studio di estensione e le riduzioni osservate durante il mantenimento sono state generalmente mantenute fino alla settimana 252.
Nei pazienti con colite ulcerosa, il trattamento con ustekinumab ha comportato una riduzione dei marker infiammatori tra cui la proteina C-reattiva (PCR) e la calprotectina fecale durante la fase di induzione; tale riduzione é stata poi mantenuta per tutta la fase di mantenimento e lo studio di estensione fino alla settimana 92.
(fonte: RCP)
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L’AGENZIA ITALIANA DEL FARMACO (AIFA)
NOVEMBRE 2014
Ustekinumab (Stelara): rischio di dermatite esfoliativa ed esfoliazione della pelle
Per la nota informativa inportante su Stelara ==> da QUI
Ustekinumab su PubMed ==> da QUI
Ustekinumab su PubChem ==> da QUI
Ustekinumab sul sito della FDA ==> da QUI
Ustekinumab su Google Scholar (ricerca globale) ==> da QUI
Ustekinumab su Google Scholar (ricerca in lingua italiana) == da QUI
COSTO
STELARA 45 mg soluzione iniettabile – uso sottocutaneo – flaconcino (vetro) 0,5 ml (90 mg/ml) – 1 flaconcino:
- Classe di rimborsabilita’: H.
- Prezzo ex factory (IVA esclusa): € 3.150,00.
- Prezzo al pubblico (IVA inclusa): € 5.198,79;
STELARA 45 mg soluzione iniettabile in siringhe preriempite – uso sottocutaneo -siringa preriempita (vetro) 0,5 ml (90 mg/ml) – 1 siringa preriempita da 0,5 ml:
- Classe di rimborsabilita’: H.
- Prezzo ex factory (IVA esclusa): € 3.150,00.
- Prezzo al pubblico (IVA inclusa): € 5.198,79;
STELARA 90 mg soluzione iniettabile – uso sottocutaneo – flaconcino (vetro) 1,0 ml (90 mg/ml)» 1 flaconcino:
- Classe di rimborsabilita’: H.
- Prezzo ex factory (IVA esclusa): € 3.150,00.
- Prezzo al pubblico (IVA inclusa): € 5.198,79;
STELARA 90 mg soluzione iniettabile in siringhe preriempite – uso sottocutaneo -siringa preriempita (vetro) 1 ml (90 mg/ml) – 1 siringa preriempita da 1 ml:
- Classe di rimborsabilita’: H.
- Prezzo ex factory (IVA esclusa): € 3.150,00.
- Prezzo al pubblico (IVA inclusa): € 5.198,79;
STELARA 130 mg concentrato per soluzione per infusione – uso endovenoso – flaconcino (vetro) – 26 ml (5 mg/ml)» 1 flaconcino
- Classe di rimborsabilita’: H.
- Prezzo ex factory (IVA esclusa): € 3.150,00.
- Prezzo al pubblico (IVA inclusa): € 5.198,79.
Prescrizione del medicinale STELARA soggetta a diagnosi – secondo a quanto previsto dall’allegato 2 e successive modifiche, alla determinazione 29 ottobre 2004 – PHT Prontuario della distribuzione diretta, pubblicata nel supplemento ordinario alla Gazzetta Ufficiale n. 259 del 4 novembre 2004.
Regime di fornitura: medicinale soggetto a prescrizione medica limitativa, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti – internista e gastroenterologo (RRL).
PIANO TERAPUTICO CARTACEO PER STELARA (USTEKINUMAB)