DABIGATRAN ETEXILATO- PRADAXA
Pagina pubblicata il 10/04/2012 – ultimo aggiornamento:04/06/2023
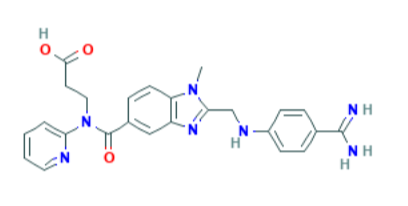
Dabigatran – formula bruta: C25H25N7O3
Dabigatran – denominazione IUPAC: 3-[[2-[(4-carbamimidoylanilino)methyl]-1-methylbenzimidazole-5-carbonyl]-pyridin-2-ylamino]propanoic acid
nome del farmaco e formulazioni:
PRADAXA 75 mg cps rigide
PRADAXA 110 mg capsule rigide
PRADAXA 150 mg capsule rigide
SCHEDA TECNICA PRADAXA (RCP) (fonte: EMA 04/06/2023)
SINTESI DI PRADAXA (DABIGATRAN E PERCHE’ E’ AUTORIZZATO NELL’UNIONE EUROPEA (fonte: EMA)
INDICAZIONI:
75 mg
Prevenzione primaria di episodi tromboembolici venosi (TEV) in pazienti adulti sottoposti a chirurgia sostitutiva elettiva totale dell’anca o del ginocchio.
Trattamento di TEV e prevenzione di TEV ricorrente in pazienti pediatrici dalla nascita a meno di 18 anni di età
110 mg
Prevenzione primaria di episodi tromboembolici venosi (TEV) in pazienti adulti sottoposti a chirurgia sostitutiva elettiva totale dell’anca o del ginocchio.
Prevenzione di ictus e embolia sistemica in pazienti adulti con fibrillazione atriale non-valvolare (FANV), con uno o più fattori di rischio, quali precedente ictus o attacco ischemico transitorio (TIA); età ≥ 75 anni; insufficienza cardiaca (Classe NYHA ≥ II); diabete mellito; ipertensione.
Trattamento della trombosi venosa profonda (TVP) e dell’embolia polmonare (EP) e prevenzione delle recidive di TVP e EP negli adulti.
Trattamento di TEV e prevenzione di TEV ricorrente in pazienti pediatrici dalla nascita a meno di 18 anni di età
150 mg
Prevenzione di ictus e embolia sistemica in pazienti adulti con fibrillazione atriale non-valvolare (FANV), con uno o più fattori di rischio, quali precedente ictus o attacco ischemico transitorio (TIA); età ≥ 75 anni; insufficienza cardiaca (Classe NYHA ≥ II); diabete mellito; ipertensione.
Trattamento della trombosi venosa profonda (TVP) e dell’embolia polmonare (EP) e prevenzione delle recidive di TVP e EP negli adulti.
Trattamento di TEV e prevenzione di TEV ricorrente in pazienti pediatrici dalla nascita a meno di 18 anni di età
CONTROINDICAZIONI
- Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1 dell’RCP.
- Compromissione renale severa (CLCr < 30 ml/min) nei pazienti adulti
- eGFR < 50 mL/min/1,73 m2 nei pazienti pediatrici
- Sanguinamento attivo clinicamente significativo.
- Lesioni o condizioni che comportino un rischio significativo di sanguinamento maggiore. Possono includere ulcera gastrointestinale in corso o recente, presenza di neoplasie ad elevato rischio di sanguinamento, recente lesione cerebrale o spinale, recente intervento chirurgico a livello cerebrale, spinale od oftalmico, recente emorragia intracranica, varici esofagee accertate o sospette, malformazioni arterovenose, aneurismi vascolari o anomalie vascolari maggiori intraspinali o intracerebrali.
- Trattamento concomitante con ogni altro anticoagulante come eparina non frazionata (ENF), eparine a basso peso molecolare (enoxaparina, dalteparina ecc.), derivati dell’eparina 42 (fondaparinux ecc.), anticoagulanti orali (warfarin, rivaroxaban, apixaban ecc.) fatta eccezione per specifiche circostanze. Tra queste il cambio di terapia anticoagulante (vedere paragrafo 4.2) quando l’ENF è somministrata alle dosi necessarie per mantenere pervio un catetere centrale venoso o arterioso oppure durante l’ablazione transcatetere per fibrillazione atriale (vedere paragrafo 4.5 dell’RCP).
- Compromissione epatica o malattia epatica che possa avere un qualsiasi impatto sulla sopravvivenza.
- Trattamento concomitante con seguenti i forti inibitori della P-gp: ketoconazolo ad uso sistemico, ciclosporina, itraconazolo e dronedarone (vedere paragrafo 4.5)dell’RCP).
- Protesi valvolari cardiache che richiedano trattamento anticoagulante (vedere paragrafo 5.1 dell’RCP)
Meccanismo d’azione
Dabigatran etexilato è un profarmaco di piccole dimensioni molecolari che non esercita alcuna attività farmacologica. Dopo somministrazione orale, dabigatran etexilato è rapidamente assorbito e convertito in dabigatran mediante idrolisi catalizzata da esterasi nel plasma e nel fegato. Dabigatran è un potente inibitore diretto, competitivo, reversibile della trombina ed è il principio attivo principale che si ritrova nel plasma.
Poiché la trombina (proteasi della serina) consente la conversione del fibrinogeno in fibrina nella cascata della coagulazione, la sua inibizione previene la formazione di trombi. Dabigatran inibisce la trombina libera, la trombina legata a fibrina e l’aggregazione delle piastrine indotta dalla trombina. (fonte: RCP)
Dabigatran su PubMed ==> da QUI
Dabigatran sul sito della FDA ==> da QUI
Dabigatran sul sito della Cochrane ==> da QUI
Nota Informativa Importante AIFA sui nuovi anticoagulanti orali Eliquis, Pradaxa, Xarelto e Lixiana (20/05/2019)
“Apixaban (Eliquis), dabigatran etexilato (Pradaxa), edoxaban (Lixiana/Roteas) e rivaroxaban (Xarelto) non sono raccomandati nei pazienti con sindrome antifosfolipidica a causa del possibile aumento del rischio di eventi trombotici ricorrenti.”
La nota infornativa importante AIFA sui NAO e rischio di eventi trombotici in pz con APS da QUI
Nota informativa importante AIFA sui nuovi anticoagulanti orali Eliquis, Pradaxa, Xarelto (11/09/2013)
” L’Agenzia Italiana del Farmaco rende disponibile nuove e importanti informazioni sui fattori di rischio per il sanguinamento – Prestare attenzione alla posologia, alle controindicazioni e alle avvertenze speciali e precauzioni d’impiego per ridurrne il rischio.
Eliquis (apixaban), Pradaxa (dabigatran etexilato) e Xarelto (rivaroxaban) sono anticoagulanti orali che hanno recentemente ricevuto l’autorizzazione per indicazioni per le quali vengono usati da decenni gli antagonisti della vitamina K (warfarin, fenprocumone e acenocumarolo) o le eparine a basso peso molecolare (EBPM). A differenza degli antagonisti della vitamina K, questi nuovi medicinali non richiedono il monitoraggio di routine dell’attività anticoagulante.
Tuttavia, negli studi clinici e nell’esperienza post-marketing è stato dimostrato che gli eventi di sanguinamento maggiore, inclusi eventi fatali, non sono limitati al solo uso degli antagonisti della vitamina K/EBPM ma sono rischi significativi anche per i nuovi anticoagulanti orali.”
La Nota informativa AIFA in PDF da QUI
INFORMATIVA AIFA DEL 7/01/2013
- con questa “nota informativa importante”, l’AIFA comunica che è stata aggiunta la seguente CONTROINDICAZIONE: Pradaxa è ora controindicato nei pazienti portatori di protesi valvolari cardiache che richiedano trattamento anticoagulante.
- Per la nota informativa completa ==> da QUI
INFORMATIVA AIFA 27/10/2011 ==> da QUI
Comunicato stampa EMA sulla sicurezza del farmaco Dabigatran del 25/05/2012 ==> da QUI
Documento in forma di domande e risposte sulla revisione del rischio di sanguinamento con Pradaxa (dabigatran etexilato) rilasciato dall’EMA il 25/05/2012 ==> da QUI
classe di rimborsabilità: A – PHT (distribuzione diretta anche da strutture pubbliche).
La classificazione ai fini della fornitura del medicinale PRADAXA (dabigatran) nelle formulazioni da 110 mg e 150 mg è la seguente (determina AIFA 5 MARZO 2019):
Nella indicazione terapeutica:
- TEV,
medicinale soggetto a prescrizione medica limitativa, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti – ortopedico/fisiatra.
Nella indicazione terapeutica:
- FANV
Con determina AIFA del 17/06/2020, per un periodo di 120 giorni, salvo ulteriori proroghe, il farmaco PRADAXA è stato reso prescrivibile da specialisti e Medici di Medicina Generale, secondo le indicazioni della NOTA AIFA n. 97 per il trattamento della fibrillazione atriale non valvolare
medicinale soggetto a prescrizione medica limitativa, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti individuati dalle regioni (RRL)
Nella indicazione terapeutica:
- TVP/EP
medicinale soggetto a prescrizione medica limitativa, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti individuati dalle regioni (RRL)
classificazione ai fini della fornitura del medicinale PRADAXA (dabigatran) nella formulazione da 75 mg (determina AIFA 5 MARZO 2019)
nella indicazione terapeutica
- «Prevenzione primaria di episodi tromboembolici in pazienti adulti sottoposti a chirurgia sostitutiva elettiva totale dell’ anca o del ginocchio».
E’ la seguente:
- Medicinale soggetto a prescrizione medica limitativa, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti – ortopedico, fisiatra (RRL)»
COSTO PRADAXA
- PRADAXA 75 mg capsula rigida – 10 x 1 capsule:
- classe di rimborsabilita’: «A»;
- prezzo ex factory (IVA esclusa): € 11,75;
- prezzo al pubblico (IVA inclusa): € 19,39;
- PRADAXA 75 mg capsula rigida – 30 x 1 capsule:
- classe di rimborsabilita’: «A»;
- prezzo ex factory (IVA esclusa): € 35,25;
- prezzo al pubblico (IVA inclusa): € 58,18;
- PRADAXA 110 mg capsule rigide – 30 capsule:
- classe di rimborsabilita’: «A»;
- prezzo ex factory (IVA esclusa): € 35,25;
- prezzo al pubblico (IVA inclusa): € 58,18;
- PRADAXA 110 mg capsule rigide – 10 capsule:
- classe di rimborsabilita’: «A»;
- prezzo ex factory (IVA esclusa): € 11,75;
- prezzo al pubblico (IVA inclusa): € 19,39;
- PRADAXA 110 mg capsule rigide – 60 capsule:
- classe di rimborsabilita’: «A»;
- prezzo ex factory (IVA esclusa): € 70,50;
- prezzo al pubblico (IVA inclusa): € 116,35;
- PRADAXA 150 mg capsule rigide – 30 capsule:
- classe di rimborsabilita’: «A»;
- prezzo ex factory (IVA esclusa): € 35,25;
- prezzo al pubblico (IVA inclusa): € 58,18;
- PRADAXA 150 mg capsule rigide – 60 capsule:
- classe di rimborsabilita’: «A»;
- prezzo ex factory (IVA esclusa): € 70,50;
- prezzo al pubblico (IVA inclusa): € 116,35;
La casa farmaceutica ha aperto un sito dedicato al pradaxa; la navigazione è consentita al personale sanitario previa registrazione: www.pradaxa.it