TICAGRELOR
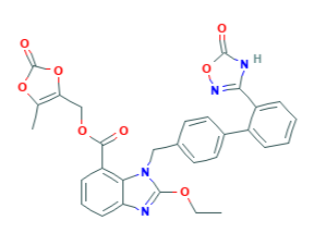
Ticagrelor formula di struttura
Ticagrelor formula bruta: C23H28F2N6O4S
Ticagrelor nome IUPAC: (1S,2S,3R,5S)-3-[7-[[(1R,2S)-2-(3,4-difluorophenyl)cyclopropyl]amino]-5-propylsulfanyltriazolo[4,5-d]pyrimidin-3-yl]-5-(2-hydroxyethoxy)cyclopentane-1,2-diol
Pagina creata il 18/04/2012; ultimo aggiornamento: 09/03/2019
Nome commerciale e formulazioni:
BRILIQUE cpr 90 mg
POSSIA cpr 90 mg (non in vendita in Italia)
SCHEDA TECNICA BRILIQUE (RCP) (fonte: EMA 01/05/2020)
riassunto della relazione pubblica europea di valutazione (EPAR) per Brilique destinato al pubblico
INDICAZIONI
Brilique, in co-somministrazione con acido acetilsalicilico (ASA), è indicato per la prevenzione di eventi aterotrombotici in pazienti adulti con
- sindrome coronarica acuta (SCA) o
- storia di infarto miocardico (IM) ed un alto rischio di sviluppare un evento aterotrombotico (vedere paragrafi 4.2 e 5.1 dell’RCP).
CONTROINDICAZIONI
- Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1 (vedere paragrafo 4.8 dell’RCP).
- Sanguinamento patologico in atto.
- Storia clinica di emorragia intracranica (vedere paragrafo 4.8 dell’RCP).
- Compromissione della funzionalità epatica severa (vedere paragrafi 4.2, 4.4 e 5.2 dell’RCP).
- Co-somministrazione di ticagrelor con forti inibitori del CYP3A4 (per es. ketoconazolo, claritromicina, nefazodone, ritonavir e atazanavir), poichè la co-somministrazione può portare ad un incremento sostanziale dell’esposizione a ticagrelor (vedere paragrafo 4.5 dell’RCP).
Meccanismo d’azione
Brilique contiene ticagrelor, appartenente alla classe chimica delle ciclopentiltriazolopirimidine (CPTP), che è un antagonista orale, diretto, selettivo e reversibile del recettore P2Y12 e previene l’attivazione e l’aggregazione piastrinica P2Y12 dipendente ADP mediata..
Ticagrelor non impedisce il legame dell’ADP, ma quando si lega al recettore P2Y12 impedisce la trasduzione del segnale indotta dall’ADP. Poiché le piastrine hanno un ruolo nell’esordio e/o evoluzione delle complicanze trombotiche della malattia aterosclerotica, l’inibizione della funzione delle piastrine ha dimostrato di ridurre il rischio di eventi CV come morte, IM o ictus.
Ticagrelor inoltre aumenta i livelli endogeni locali di adenosina attraverso l’inibizione del trasportatore nucleosidico equilibrativo -1 (ENT-1).
Ticagrelor ha dimostrato di aumentare i seguenti effetti adenosina-indotti in soggetti sani e in pazienti con SCA: vasodilatazione (misurata come aumento del flusso sanguigno coronarico in volontari sani e in pazienti con SCA; mal di testa), inibizione della funzione delle piastrine (nel sangue umano intero in vitro) e dispnea.
Tuttavia, non è stato chiarito il legame tra l’aumento osservato dell’adenosina e gli esiti clinici (ad es.: morbilità-mortalità).
(fonte: RCP)
Ticagrelor su PubMed ====> da QUI
Ticagrelor sul sito della FDA ==> da QUI
Ticagrelor sul sito della Cochrane ==> da QUI
COSTO
Brilique 90 mg – compresse rivestite con film – uso orale – blister 56 compresse (conf. calendarizzata);
- classe di rimborsabilità: «A»;
- prezzo ex factory (IVA esclusa): € 68,04;
- prezzo al pubblico (IVA inclusa): € 112,29;
Brilique 60 mg – compressa rivestita con film – uso orale – blister 56 compresse (confezione calendarizzata);
- classe di rimborsabilità: «A»;
- prezzo ex factory (IVA esclusa): € 68,04;
- prezzo al pubblico (IVA inclusa): € 112,29.
Prescrizione del medicinale soggetta a diagnosi – piano terapeutico (PT) come da scheda allegata alla determinazione AIFA 22/05/2017 e a quanto previsto dall’allegato 2 e successive modifiche, alla determinazione 29 ottobre 2004 – PHT Prontuario della distribuzione diretta -, pubblicata nel supplemento ordinario alla Gazzetta Ufficiale n. 259 del 4 novembre 2004.
PRESCRIVIBILITA‘
medicinale soggetto a prescrizione medica (RR).